РЕАКЦІЯ ШЕНЕМАНА (нім. Schönemann) — аналітична реакція виявлення (ідентифікації) групи отруйних речовин нервово-паралітичної дії похідних фосфатної та алкілфосфонової кислот п’ятивалентного Фосфору загальної формули:
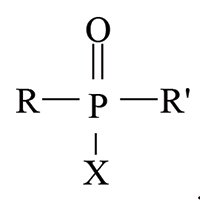
де R — алкіл або алкоксигрупа; Rʹ — алкоксi-, алкілмеркапто-, заміщена при атомі Нітрогену аміногрупа; Х — замісник, зв’язок якого з атомом Фосфору менш стійкий порівняно з таким з R та Rʹ. Це може бути F, CN, ацилоксі-, діалкіламіноетилмеркапто-, нітрофеноксигрупа, залишок заміщених фосфатної чи алкілфосфонової кислот. Р.Ш. була відкрита у 1944 р. німецьким хіміком Шенеманом під час дослідження ним добутих у Німеччині отруйних речовин нервово-паралітичної дії під умовною назвою «трилон». Р.Ш. заснована на зростанні швидкості окиснення первинних ароматичних амінів гідроген пероксидом у присутності похідних фосфатної та алкілфосфонової кислот п’ятивалентного Фосфору за рахунок утворення відповідних пероксидних похідних — пероксокислот, генерованих при взаємодії їх із гідроген пероксидом в лужному середовищі. Реакція за механізмом ідентична лужному гідролізу:
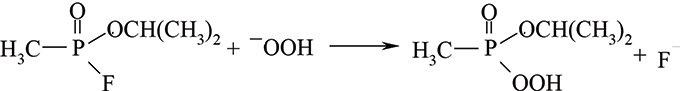
У лужному середовищі (рН≥8,3) у присутності 3% Н2О2 гідролітичне розкладення фторангідридів алкілфосфонових кислот відбувається приблизно у 50 разів швидше, ніж під час лужного гідролізу. Утворена пероксокислота ізопропілового естеру метилфосфонової кислоти дуже нестійка. У разі її дисоціації пероксидний аніон, будучи сильним окисником, здатний окиснювати ароматичні аміни до забарвлених діазосполук:
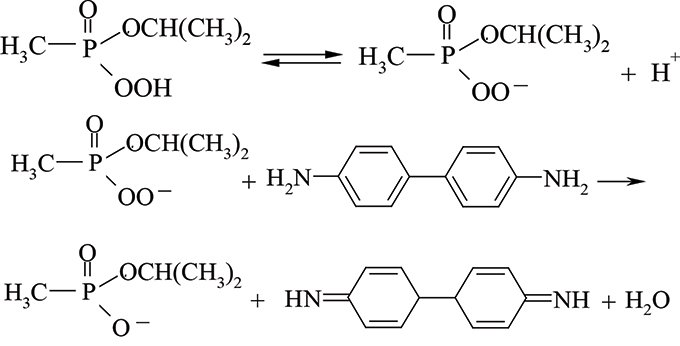
Цю реакцію застосовують для ідентифікації групи отруйних речовин фосфатної та алкілфосфонової кислот п’ятивалентного Фосфору у військовій справі, а також для визначення інсектицидів типу естерів фосфатної кислоти, таких як меркаптофос, дихлофос, хлорофос та фосфамід тощо. Українські вчені запропонували використовувати Р.Ш. як індикаторну на ацетилхолін та суксаметоній хлорид під час ферментного (біохімічного методу за інгібуванням холінестерази) визначеннянизки інгібіторів холінестераз (пестицидів чи отруйних речовин та БАР) на нанограмовому та мікрограмовому рівні. Р.Ш. є груповою реакцією, перебіг якої відбувається не лише з відповідними фосфорорганічними сполуками, але також і з іншими речовинами, що утворюють із гідроген пероксидом пероксидні похідні. Так, альдегіди, ангідриди та галогенангідриди арилсульфонових кислот реагують аналогічно. Подібні сполуки заважають виявленню чи визначенню фосфоровмісних сполук. Заважають визначенню також і катіони перехідних металів, напр., Купруму(II), Феруму(III), Мангану(II), які іноді наявні у воді, а також є неспецифічними технологічними домішками у хімічних реактивах. Для добування необхідного для окиснення активного окисника використовується гідроген пероксид або зручні у застосуванні неорганічні пероксидні сполуки, такі як натрій надпероксид, натрій пероксоборат або натрій пероксодифосфат. Як зазначено, при цьому передбачається утворення як проміжного продукту відповідної пероксокислоти, як показано вище на рисунку, P.Ш. можна розглядати як реакцію гідролітичного розщеплення за участю гідрогенпероксид-іону, який, завдяки притаманному йому α-ефекту, володіє сильними нуклеофільними властивостями, а тому приводить у реакціях нуклеофільного заміщення за позитивно поляризованим атомом Фосфору (V) естерів до утворення відповідних солей пероксокислот, які мають вищий оксидаційний потенціал, ніж власне гідроген пероксид, внаслідок чого пришвидшується реакція окиснення присутніх у системі ароматичних амінів (індикаторних речовин). З іншого боку, ці дві реакції можна розглядати як спряжені (хімічно індуковані), які мають принаймні один спільний реагент — гідроген пероксид (актор) і одночасно відбуваються у системі. Перша реакція, в якій визначувана речовина (індуктор) за рахунок взаємодії з актором приводить до утворення високореакційноздатної пероксидної сполуки, прискорює (індукує) іншу — реакцію окиснення реактором ароматичного аміну, який виступає тут у ролі акцептора (див. Спряжені реакції). Едвардс і Пірсон окреслили клас нуклеофілів, які виявляють винятково високу реакційну здатність стосовно різних субстратів залежно від їх основності. Цей клас структурно характеризується наявністю неподіленої пари електронів на суміжному атомі, або у α-положенні відносно нуклеофільного атома. Таке прискорення швидкості у науковій літературі відоме також як α—ефект. Цей ефект особливо притаманний неіонізованим нуклеофілам, таким як Н2О2, а також аніонним нуклеофілам, таким як пероксоаніони, але різною мірою до різних субстратів.
Р.Ш. застосовується досьогодні головним чином для визначення фосфоровмісних отруйних речовин у трьох різних аналітичних методах: фотометричному, флюорометричному та хемілюмінесцентному. Способи різняться складністю апаратурного оформлення та природою використовуваної індикаторної речовини (див.Кінетичні методи аналізу).Так, у колориметричному методі відповідно до наведеного вище рівняння, як індикаторна речовина використані о-діанізидин, о-толідин, а також останнім часом — їх неканцерогенний аналог 3,3,5,5ʹ-тетраметилбензидин. У флуоресцентному способі як індикаторна речовина застосований індол, який в результаті окиснення при рН 9 через флуоресціюючий індоксил та біле індиго перетворюється в індиго (див. Флуоресценція):
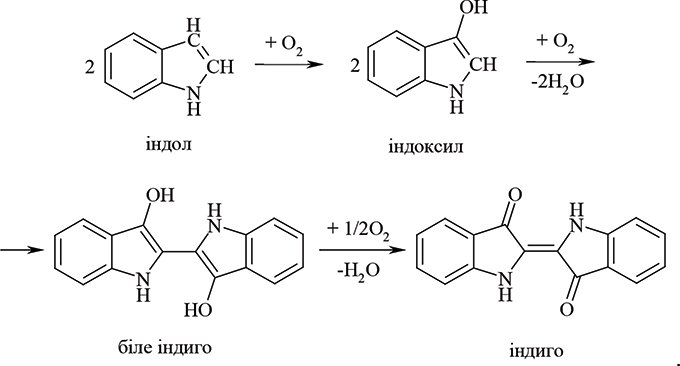
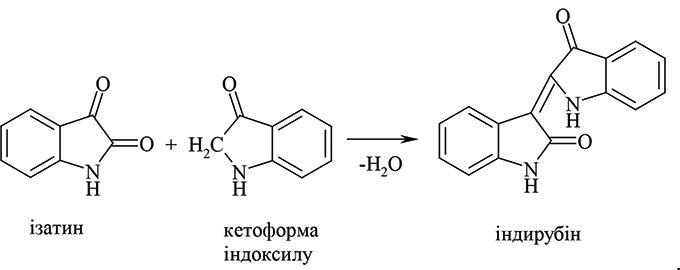
При цій модифікації Р.Ш. поряд із вимірюванням флуоресценції визначають також інтенсивність синього забарвлення індиго, напр., за допомогою індикаторної трубки. Для стабілізації флуоресціюючих продуктів рекомендується додавати ацетон або гліцерин. Присутність індоксилу можна також встановити, додаючи до реакційної суміші ізатин і спостерігаючи за утворенням забарвленого індирубіну:
У хемілюмінесцентному методі як реагент застосовується хемілюмінесцентний індикатор люмінол (5-аміно-2,3-дигідрофталазиндіон-1,4) (див. Хемілюмінесцентні індикатори, Хемілюмінесцентний аналіз). Метод полягає у вимірюванні блакитно-синьої хемілюмінесценції, яка спостерігається при світловому окисненні люмінолу утвореною пероксокислотою. Механізм перетворень люмінолу, який приводить до виникнення хемілюмінесценції, передбачає на першій стадії утворення аніона люмінолу, а після цього — окиснення його пероксокислотою до діазохінону з подальшим утворенням через трансулярний пероксид люмінолу до емітера хемілюмінесценції — діаніона амінофталатної кислоти. Ця схема сьогодні вважається найвірогіднішою:
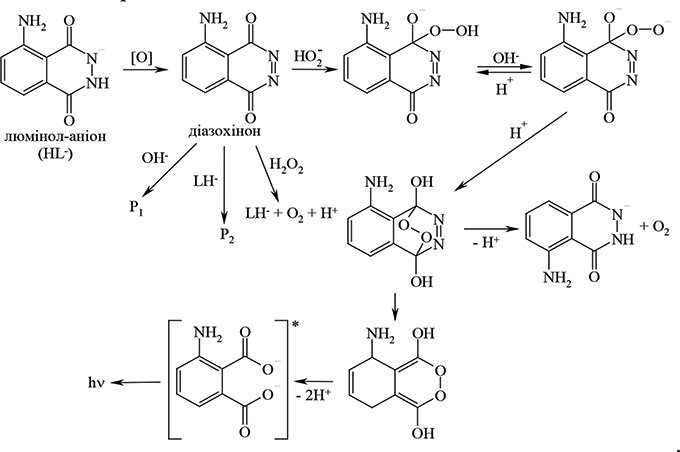
Встановлено, що у разі зарину хемілюмінесценція має два максимуми, з яких перший короткочасний, зумовлений сполукою, що утворюється у вищенаведеній реакції, а другий, більш тривалий, викликаний окисненням люмінолу оксигеном, що виділяється. Додавання галогенідів лужних металів підвищує чутливість методу, мабуть, за рахунок проміжного утворення гіпогалогенідів. Хіміко-аналітичні дослідження Р.Ш. продовжуються.
Александров В.Н., Емельянов В.И. Отравляющие вещества: Учеб. пособ. — 2-е изд., перераб. и доп. — М.: Воениздат, 1990; Блажеєвський Микола. Кінетичні методи визначення токсичних речовин з використанням реакцій пергідролізу та пероксикислотного окиснення // Праці НТШ. Хем. Біохем. 2008. — Т. 21; Крамаренко В.П. Токсикологічна хімія. — К., 1995; Франке З., Франц П., Варнке В. Химия отравляющих веществ. Т. 2. / Пер. с нем. — М.: Химия, 1973; Blazheyevski M.Ye. The application of kinetic methods in pharmaceutical analysis // Methods and objects of chemical analysis. — 2011. — Т. 6, № 1; Schönemann. Eine neune Reaktion für den Nachweis von labilen Nichtmetall-Halogen-Bindungen, P.B. 119887, U.S. Department of Commerce, 1944.
